大阪大学 大学院理学研究科 教授 今田 勝巳(いまだ かつみ)
TEL:06-6850-5455/5456 FAX: 06-6850-5455
E-mail: kimada@chem.sci.osaka-u.ac.jp
世界初!生物モーターのパワーアップアイテム細菌べん毛モーターの出力強化蛋白質FliLのしくみを解明 〜哺乳類から細菌まで共通の構造〜
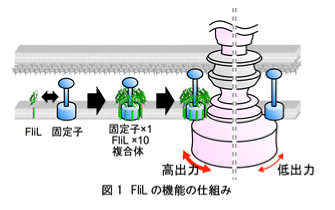
大阪大学大学院理学研究科の今田勝巳教授、竹川宜宏日本学術振興会特別研究員、名古屋大学大学院理学研究科の本間道夫教授の共同研究グループは、細菌のべん毛モーターをパワーアップする蛋白質、FliLの構造と機能のしくみを世界で初めて明らかにしました(図1)。
細菌はべん毛と呼ばれるらせん状の繊維を、蛋白質でできた小さなモーターを使ってスクリューのように回して泳ぎます。べん毛モーターには電気モーターと同様に回転子と固定子があり、両者の相互作用で力が発生します。粘性のある液体中を泳ぐなど負荷が高くなるとべん毛モーターは出力を上げますが、このときFliL蛋白質が必要です。遺伝子変異でFliLを失った細菌は高粘性下での運動能を失います。細菌は、ヒトなどに感染するときに粘液中や宿主の細胞表面など粘性が高い場所を移動するため、FliLを失うと感染力も失われます。しかし、FliLがモーターの高出力化にどのように寄与するのか、長い間謎でした。今回、共同研究グループは、X線結晶構造解析によりFliLの立体構造を世界で初めて解明しました。その結果、FliLは10個の分子からなるリング状の複合体を形成すること、哺乳類の神経や赤血球などにも存在するストマチン様蛋白質と共通の構造を持つことが明らかになりました。ストマチン様蛋白質は外部刺激を受け取り、イオンチャネルなどの多様な膜蛋白質の活性を制御することが知られています。しかし、ストマチン様蛋白質が具体的にどのような分子機構により機能を発揮するかに関してはほとんど分かっていません。本研究では、FliLが固定子の周りを取り囲むように複合体を形成し、FliLリングの内壁が固定子と相互作用して固定子を活性化することを明らかにしました(図1)。本研究から得られた知見は、細菌モーターの出力強化のしくみだけでなく、上述のストマチン様蛋白質のような哺乳類や植物を含めた全ての生物における膜蛋白質の活性制御の共通機構を明らかにすることに繋がります。
本研究成果は、2019年3月19日(火)19時(日本時間)、米国科学誌「mBio」にオンライン公開されました。