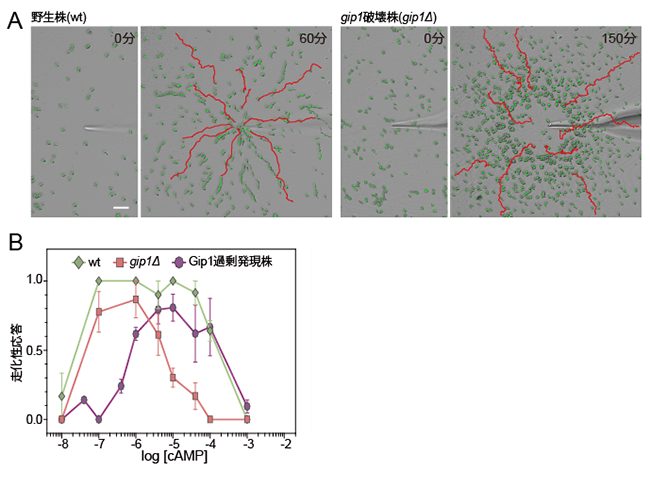
A:粘菌細胞に、マイクロピペットから走化性物質であるcAMPを拡散し濃度勾配を与えた。60分後の野生株および150分後のgip1破壊株の細胞の軌跡を赤線で示している。細胞は緑色で表示。野生株はピペットの先端まで濃度勾配をさかのぼることができるが、gip1破壊株は途中で止まっている。つまり、cAMP濃度が高いマイクロピペットの先端付近で、gip1破壊株は走化性能を失っていることを示している。
B:さまざまな濃度のcAMPに対する細胞の走化性能の検定をした。野生株(薄緑線)に比べて、gip1破壊株(ピンク線)では高濃度で走化性能が低下しており、Gip1過剰発現株(紫線)では低濃度で走化性能が低下している。
走化性細胞が応答範囲を拡張するメカニズム-生物が環境適応する仕組みの一端を解明-
理化学研究所(理研)生命システム研究センター細胞シグナル動態研究グループの上田昌宏グループディレクター(大阪大学大学院生命機能研究科 教授(研究当時:理学研究科))らの研究チームは、「走化性」における応答範囲を調節する因子「Gip1」を発見しました。この因子は、三量体Gタンパク質の細胞内局在制御というこれまで知られていなかったメカニズムで、走化性の応答範囲を拡張していることが分かりました。
細胞は化学物質の濃度勾配に沿って移動することができます。このような現象は「走化性」と呼ばれ、胚発生、免疫、神経回路形成、傷口の治癒などに重要な役割を果たしています。走化性細胞は10万倍にも及ぶ広い化学物質の濃度範囲にわたって、数%程度の微小な濃度差を認識できます。このような性質は生物の持つ柔軟な環境適応の仕組みとして、古くから注目を集めてきました。
今回、研究グループは、走化性応答の濃度範囲を広げるタンパク質Gip1を同定しました。この因子は細胞膜上での三量体Gタンパク質の量を調節し、受容体からのシグナルを適正に伝達していました。Gip1は三量体Gタンパク質との結合を介してその一部を細胞質画分として保持し、外界の化学物質の増加に応じて細胞質内の三量体Gタンパク質を細胞膜へ送り出していました。このような三量体Gタンパク質の局在調節という新たなメカニズムにより、走化性細胞は適切に濃度勾配を認識し、応答範囲を拡張していました。
走化性細胞を含め多くの感覚細胞は、広範な刺激に対して応答できます。このような応答範囲の拡張メカニズムとして、受容体の化学修飾による制御がこれまで広く知られていました。今回の研究では三量体Gタンパク質の局在制御という新しいメカニズムも、その調節に関わっていることを突き止めました。このような制御は真核生物で広く保存されている可能性があり、三量体Gタンパク質がGip1との結合により細胞質にとどめられる仕組みなど、その分子基盤に関する知見が今後、他のシステムでの理解に貢献すると期待できます。
本研究は、米国の科学雑誌『Proceedings of National Academy of Science of the United States of America (PNAS)』に掲載されるのに先立ち、オンライン版(4月5日付け)に掲載されました。
理化学研究所 生命システム研究センター 細胞シグナル動態研究グループ
グループディレクター 上田 昌宏(うえだ まさひろ)
(大阪大学大学院 生命機能研究科 教授(研究当時:理学研究科))
E-mail:masahiroueda@fbs.osaka-u.ac.jp, masahiroueda@riken.jp












